摘要
消毒剂能有效抑制或杀死微生物,消毒剂在我国的家畜、家禽、水产和食用真菌的养殖业中广为应用。本文综述了近年来微生物对消毒剂耐药性的研究,从消毒剂耐药性定义切入,着重从微生物通过形成生物膜、借助外排泵系统、产生相关特异性酶、改变靶点、降低细胞膜、壁通透性等方式产生抗性的机制进行综述,同时论述了实验室常用微生物耐药性检测方法及耐药性控制措施,利用措施尽可能减小消毒剂耐药性的影响。
关键词
消毒剂 耐药机制 生物膜 耐药检测 控制措施
消毒剂是一类可用于物体表面以及空气、水等传播介质中抑制或杀死微生物的化学物质,科学合理使用消毒剂能有效切断病原微生物传播途径,但长期不合理地使用消毒剂会降低其有效性,甚至会诱导微生物产生抗性[1]。
消毒剂的耐药性定义为细菌对常用浓度的消毒剂敏感性下降,即消毒剂在常规的作用浓度和时间下,不能将细菌有效抑制或者杀灭,这种抗性与消毒剂对某微生物的作用浓度、作用时间等有关[2,3]。细菌与消毒剂多次接触后,使该类消毒剂的最小抑菌浓度或最小杀菌浓度 (MIC或MBC)升高的现象[4]。
消毒剂由于长期或过量使用,经稀释残留进入环境,可能对环境微生物生态多样性产生影响。微生物会通过表型适应、基因突变和水平基因转移等方式提高对消毒剂的耐受性或产生抗性基因。微生物消毒剂性抗基因的获得和转移可由染色体介导,也可由质粒介导。一般来说,染色体介导的抗性基因主要通过传代过程垂直传播或者同种间传播,而质粒介导的抗性更容易引发抗性基因在不同种属间的水平转移而增加抗性及抗性基因的传播风险[1]。
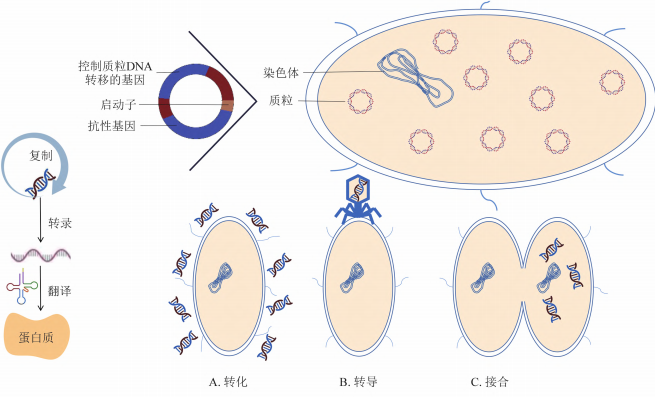
图1.消毒剂抗性基因及转移传播方式示意图[1]
1、消毒剂耐药性分类
消毒剂抗性产生的机制包括天然耐药和获得性耐药等多个方面。天然耐药主要是由于细菌本身的生化结构造成的,受染色体控制的特性。某些菌株由于具有特殊的生化结构,从而起到消毒剂屏蔽作用,产生天然耐药,如外膜蛋白、脂多糖等[2,4]。固有性耐药在微球菌和革兰阴性菌中更为常见[5]。
获得耐药性是指细菌通过非固有遗传性状而获得的耐药性[5],细菌通过获得质粒、转座子或发生基因突变而产生对消毒剂的耐药性,使其不被消毒剂杀灭,质粒介导的耐药性的获得为主要途径,细菌的获得性耐药可因不再接触消毒剂而消失,也可由质粒将耐药基因转移给染色体而代代相传[4]。
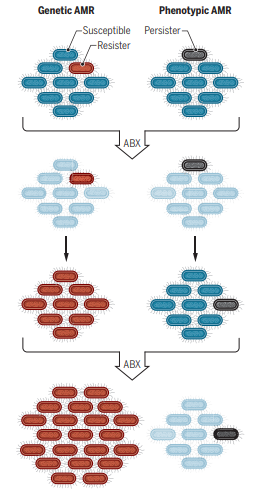
图2. 耐药性基因遗传和表型[6]
在一定环境和选择压力下,消毒剂抗性微生物的抗性基因可通过垂直和水平转移迅速传播,一方面会降低消毒剂的消毒效率;另一方面,这种基因污染物可能对生态环境和人类健康构成严重威胁。在实际环境中,微生物可能会利用多种机制策略抵抗消毒剂作用[1]。
2、微生物对消毒剂耐药机制
细菌耐药机制复杂,往往是多种耐药机制同时存在或者协同作用。根据目前研究,微生物消毒剂抗性机制基本可分为为形成生物膜、借助外排泵系统、产生相关特异性酶、改变靶点、降低细胞膜、壁通透性等。如图3所示:
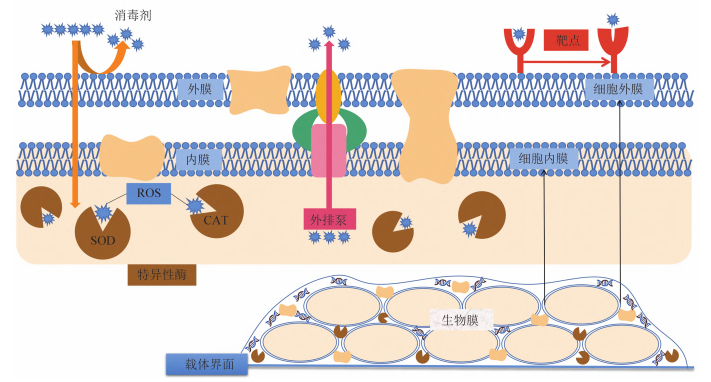
图3. 消毒剂耐药性机理类型[1]
2.1 形成生物膜耐药机制
微生物多糖包被分泌物和胞外聚合物将自身包绕形成生物膜产生对消毒剂的耐药性[1]。生物膜阻碍消毒剂的有效扩散,并与消毒剂产生交互作用,影响消毒剂与细菌的接触,而表现出耐药性。细菌形成BF(生物膜)的糖被会阻挡消毒剂进入细胞,糖被是一种聚阴离子聚合物,在生物膜中具有离子交换树脂的作用,当置于消毒剂中,糖被会吸收大量的消毒剂分子,使得消毒剂分子的扩散受影响,活性分子不能进入细胞和靶位点作用,从而保护生物膜中细菌免受作用[7]。如单核细胞增生李斯特菌在过氧乙酸处理后,容易形成静态和连续流动生物膜,并对苯扎氯铵和过氧乙酸消毒剂的抗性增高。分析发现消毒剂的使用促使与形成生物膜和抗性相关的热激响应转录因子hrcA和分子伴侣dnaK表达增加,从而产生抗性。用乙醇处理金黄色葡萄球菌后,与生物膜形成相关的基因icaA和icaD转录水平显著提高,这些基因的表达有助于细胞间多糖黏附素生成而形成生物膜[1]。铜绿假单胞菌和荧光假单胞菌可诱导磷酸盐降解、脂质生物合成和多胺生物合成的调节因子,有助于提高生物膜的抵抗力和恢复力,产生对戊二醛的抗性。
2.2 借助外排泵系统实现耐药性
一些抗性微生物面对消毒剂的威胁时,通过外排泵外排策略快速、有效地减少细胞内的消毒剂剂量,从而实现抗性[1]。细菌外排泵是指位于细菌细胞膜上具有特殊结构且需要能量运行的一类转运蛋白,主要由外膜通道蛋白、融合蛋白、外排蛋白三部分组成,并且外排泵系统的类型十分复杂。如qacE是属于小多重耐药家族(SMR)的外排泵基因,其编码对季铵盐类消毒剂具有外排作用的外排泵从而导致对该类消毒剂的的耐药性。氯己定的外排泵基因可以明显的增加氯己定的MIC值,降低氯己定的杀菌效果[3]。沙门菌对季铵盐消毒剂的耐药性是由于位于沙门菌多重耐药质粒的qacEΔ1基因的编码蛋白属跨膜蛋白,依靠质子运动力反向转运,主动将消毒剂自菌体细胞排出[8]。苯酚及其类似物如三氯生,这类消毒剂的耐药机制有着本身所具有的特点,细菌可以通过消毒剂的灭活作用改变靶点和外排泵介导产生对消毒剂的耐药性[1,3]。
2.3 产生相关特异性酶形成耐药机制
通过产生灭活酶或钝化酶等特异性酶作用,使消毒剂的作用减轻或者消除。微生物面对消毒剂的作用可能产生具有特定功能的酶,调节自身,增强对消毒剂的耐受性,一些分子伴侣、调节蛋白、辅酶因子等也在其中起到辅助作用[1]。此外,细菌的耐药基因可产生某些酶,使消毒剂降解而表现出耐药性[4]。如微生物可以分泌乙醛脱氢酶水解醛类,甲醛脱氢酶可催化醛的歧化反应,大多依赖谷胱甘肽和辅酶发挥降解作用,可以协助恶臭假单胞菌降解甲醛、乙醛、丙醛等醛类消毒剂;过氧化氢酶和过氧化物歧化酶可以分解氧化型杀菌剂[1]。
2.4 改变作用靶点产生耐药性
微生物可以通过在结合位点或结合位点附近进行突变或酶修饰,使靶点发生物理改变,从而减少与消毒剂的结合[1]。如大肠埃希菌和单核增多李斯特菌可以改变作用靶点对三氯生产生耐药性等[1,3]。三氯生在大肠杆菌中的耐药性就是由于编码脂肪酸合成中的enoyl酰基载体蛋白还原酶FabI基因发生了突变,使得三氯生无法结合FabI酶而发挥杀菌作用,因此菌体产生了耐药性。
2.5 降低细胞膜、壁通透性产生耐药性
一些微生物可通过降低细胞膜、细胞壁通透性,减少或阻止消毒剂进入微生物细胞内,提高对消毒剂的抗性。细菌细胞表面携带负电荷,常通过阳性离子维持细胞膜的稳定性。QACs(季铵盐类化合物)是阳离子型表面活性剂和抗菌剂,可通过正电荷与细胞膜相互作用,其抗菌活性是N-烷基的功能。N-烷基赋予QACs亲脂性特征,通过阳性氮基团与细菌细胞膜上酸性磷脂的结合,疏水端整合入细菌疏水膜的核心,在高浓度时,QACs通过形成混合胶束聚集来溶解疏水细胞膜成分(图4)。总体来说,QACs发挥抗菌活性主要依靠破坏和变性蛋白和酶、破坏细胞膜整体性和使细胞内含物泄漏等[8]。
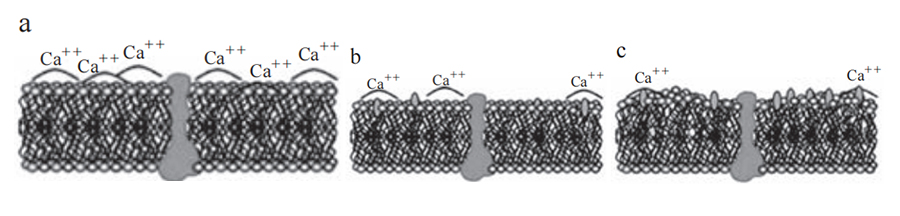
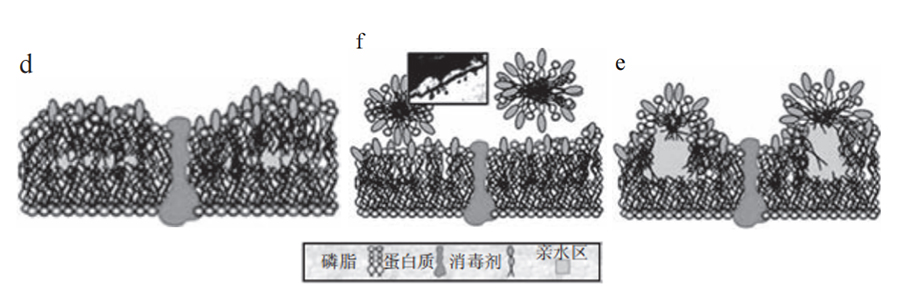
图4. QACs(季铵盐类化合物)反应机理示意图[9]
a.QACs吸收后插入酸性磷脂分子层;b、c. 磷脂分子层流动性减弱,细胞膜产生空洞;d~f. 细胞膜中蛋白功能受损,细胞膜裂解,磷脂和蛋白溶解进QACs和胶团中溶解度增加。
如铜绿假单胞菌对季铵盐的抗性就是由于细胞膜上脂多糖中脂肪酸的组成发生了变化,从而限制了季铵盐进入细胞体内。脂肪酸的长链烃基是疏水性的非极性基团, 亲水端暴露在膜的外表面,疏水端位于膜内。细胞膜上多不饱和脂肪酸上一个基团受到攻击,导致碳链的氧化、断裂及缩短,并释放小的脂肪族产物 ,磷脂膜的这些改变引起细胞膜具有亲水特性的核心部分结构改变[10]。细胞膜中不饱和脂肪酸增加可增强膜的流动性,强化细菌对消毒剂的抗性;而细胞膜中阴离子磷脂减少或阳离子磷脂增加可使净负电荷减少,同时脂质表面带正电荷的基团阻碍了阳离子消毒剂与细菌表面的相互作用,导致细菌对阳离子消毒剂产生抗性[11]。
在鼠伤寒杆菌、大肠杆菌和沙门氏菌中,内膜蛋白YejM依赖镁离子而具有磷酸酶活性,可以调节外膜中甘油磷脂(PL)和脂多糖(LPS)的平衡,从而改变外膜通透性来抵抗消毒剂[1,12]。
参考文献:
[1]张可玟,胡泓,陈刚.微生物消毒剂抗性机理[J].生物化学与生物物理进展,2022,49(01):34-47.
[2]李祥,鲁辛辛.肺炎克雷伯菌对消毒剂抗性的研究进展[J].临床检验杂志,2019,37(01):55-56.
[3]蔺飞,贾旭,凌保东.鲍曼不动杆菌对消毒剂耐药机制的研究[J].中国抗生素杂志,2017,42(2):81-89.
[4]邢玉斌,索继江,贾宁,魏华,袁云娥.细菌的消毒剂耐药性[J].微生物学报,2006,33(3):184-188
[5]叶慧芬,曾俊韶,冯毅.金黄色葡萄球菌对消毒剂的抗性及研究进展[J].中国消毒学杂志,2020,37(07):540-544.
[6]Schrader, Sarah M.; Vaubourgeix, Julien; Nathan, Carl (2020). Biology of antimicrobial resistance and approaches to combat it. Science Translational Medicine, 12(549).
[7]赵凯丽,李武平.微生物产生消毒剂抗性研究进展[J].中国感染控制杂志,2016,15(08):633-636.
[8]李帼宁,黄校樑,何杏欣,罗侠平,周少雄.沙门菌耐药性及其耐消毒剂基因的分析[J].热带医学杂志,2021,21(01):40-43.
[9]邹立扣,吴国艳,程琳,何雪梅,郭丽娟,龙梅.季铵盐类消毒剂及大肠杆菌对其耐药性研究进展[J].食品科学,2014,35(17):338-345.
[10]李喜艳,王加启,卜登攀,魏宏阳,胡菡,周凌云.多不饱和脂肪酸对细胞膜功能影响的研究进展[J].生物技术通报,2009(12):22-26.
[11]吴舜,周燕.细菌对消毒剂的检测方法与耐药机制研究进展[J].海南医学,2018,29(08):1142-1145.
[12]Gabale U, Palomino P A P, Kim H, et al. The essential inner membrane protein YejM is a metalloenzyme.. Sci Rep-UK, 2020,10(1): 17794